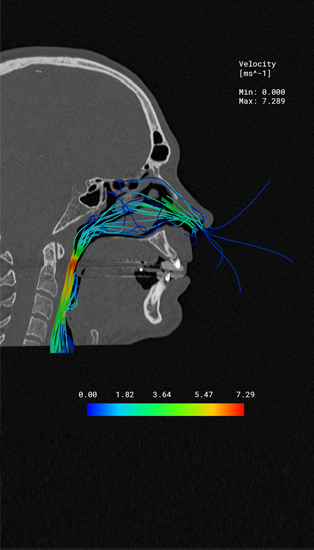
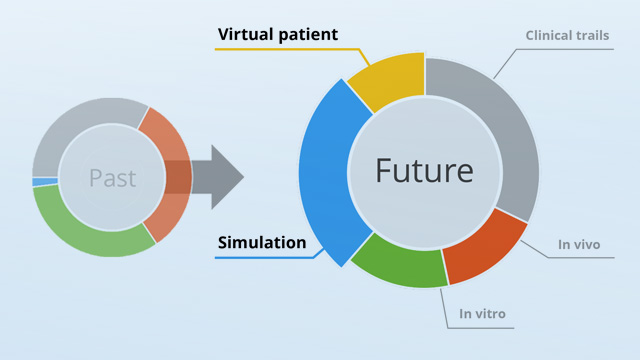
Computergestützte Simulation revolutioniert die Medizintechnik durch präzise Darstellung des Verhaltens von Medizinprodukten im virtuellen Patienten – bereits während der Entwicklung.
Mit Simq die numerische Simulation in Medizin und Medizintechnik nutzen.
Mittels Simulation lassen sich komplexe Vorgänge und Belastungen im Patienten virtuell - in silico - darstellen. Damit können Sie den zeitlichen Aufwand klinischer Studien in allen Test- und Zulassungsphasen signifikant verkürzen. Durch die im medizinischen Umfeld nutzbaren Simulationstechnologien von Simq reduzieren Sie Kosten und verschaffen Ihren Projekten einen zeitlichen Vorsprung.
Entwicklungssprung
In silico testing – ein Meilenstein zukünftiger Medizinproduktentwicklung
Computermodellierung und Simulation haben sich in hochkomplexen und kritischen Technologiesektoren wie Luft- und Raumfahrt, Chip-Design oder Energietechnik bestens bewährt. Diese zuverlässigen Simulationsmethoden haben das Potential, die Zulassung von Medizinprodukten zu revolutionieren, indem sie Prüfungen in vitro und in vivo zuverlässig durch in silico ersetzen können. Zukünftig wird der Einsatz von ethisch schwierigen Tier- und Humanversuchen auf die Ebene des virtuellen Versuchsaufbaus inklusive virtueller Patienten verlagert und bietet so frühzeitig die Möglichkeit, Produktentwicklungen sicher zu testen und anzupassen. Eine beschleunigte Medizinproduktezulassung wird damit möglich und auch zeitlich planbar.
Digitale Verifizierung
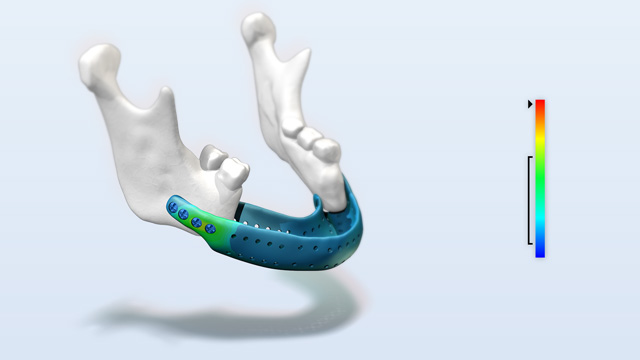
Festigkeitsbeurteilung patientenspezifischer Implantate
Die Rekonstruktion eines Kiefers nach Tumorresektionen ist eine große Herausforderung. Hierfür werden oft patientenspezifische Implantate gefertigt. Bislang wurden diese Implantate nur auf der Basis von Erfahrungen konstruiert und konnten nicht geprüft werden. Mit der von Simq eigens entwickelten Software docq VIT ist es möglich, mit geringem Aufwand die Sicherheit und Leistungsfähigkeit patientenindividueller Medizinprodukte, z.B. Implantate, unter realitätsnahen Belastungen abzubilden und nachzuweisen.
Simulationstechnologie für die Medizin mit Simq
Als kompetenter Projekt- und Service-Partner unterstützt und begleitet Simq seine Kunden bei allen Fragen rund um die Vorbereitung, Planung und Implementierung numerischer Software in Medizintechnik-Unternehmen. Unsere Leistungen sind zertifiziert nach ISO 13485. Hochspezialisiert und als eigenständiges Schwesterunternehmen von CADFEM betreuen wir viele namhafte Kunden im Bereich Medizin und Medizintechnik. Besuchen Sie gern unsere Website simq.de für weitere Informationen oder nehmen Sie hierüber direkt Kontakt mit Simq auf.